知识目标:
1、知道原子是由原子核和核外电子构成的
2、初步学会根据实验现象,来推导原子的组成
3、能够根据相对原子质量求算相对分子质量
4、逐步建立物质无限可分的观点
教学重点、
1、从微观角度来理解化学反应的本质;
2、相对质量的计算
3、原子的构成
讲述:构成物质的微粒可以分成原子、分子、离子等。分子又是由原子构成的,那么原子又是有什么构成的?原子学说的提出者——道尔顿认为,原子是一种极其微小,不可分割的微粒。对于原子是否可以再分,原子的结构到底如何的问题,科学家进行了长达近一个世纪的研究、探讨、论证。
展示:汤姆生发现电子的阴极射线的实验过程,并介绍枣糕型原子模型
展示:卢瑟福的α粒子散射实验(α粒子,即氦原子的原子核)
现象:绝大部分的α粒子沿着原来的行进方向,没有发生偏转;少部分α粒子的运动方向有所改变;甚至有极少数的α粒子有很大的偏转,甚至是180度。
提问:请大家来解释一下这种现象的原因?
讨论:对于这种现象,利用汤姆生的原子理论是无法解释的,因此作为汤姆生的学生,卢瑟福提出了自己的原子模型的设想:他认为原子中,原子核居于中央,它集中了原子的全部正电荷以及几乎所有的质量,而电子带负电,在核外很大的空间内作无规则的高速运动。
解释:因为原子核外有很大的空间,几乎是空心的,所以大部分的α粒子能够很顺畅的通过;因为α粒子粒子带正电荷,原子核也带正电荷,同种电荷相互排斥,由于斥力的原因,所以有少数的α粒子会有偏转;而因为金原子中原子核存在,而且体积小,质量大,所以只有很少的机会与α粒子相碰撞,并且能反弹。
提问:原子带电吗?为什么?
回答:原子本身不带电,由于原子核与电子两者所带的电荷电量相等,电性相反,所以原子呈电中性。
设问:物质可以分为原子、分子、离子,分子能分为原子,原子又能分为原子核与电子,那么原子核能不能再分了呢?卢瑟福同样通过α粒子散射实验,将金原子改为氮原子,发现了原子中含有质子,经过其他的科学家的不懈努力,终于发现原子核中由质子和中子构成的。一个质子带一个单位的正电荷,而中子不带电。
小结:1、原子的构成情况:
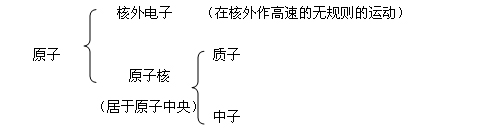
原子 核外电子 原子核 质子 中子 (在核外作高速的无规则的运动) (居于原子中央)
不带电的微粒:中子、原子(分子);
带负电荷的微粒:电子;
带正电荷的微粒:原子核、质子
3、电量关系:
核电荷数=质子数(原因是中子不带电);质子数=电子数(原因是原子不带电)
所以在原子中:核电荷数=质子数=电子数
4、质量关系:
m(原子)=m(原子核)+m(电子)≈m(原子核)[原因是一个电子的质量很小,可以忽略]
由于一个原子的真实质量很小,使用不方便,提出一个相对原子质量的概念
相对原子质量:一种碳原子(质子数为6,中子数为6的碳原子)的质量的1/12作为基准,其他原子的质量与这个基准的比值。
公式表达式:
Ar(原子)=![]()
引申:相对分子质量:构成分子的各原子的相对原子质量的总和。
Mr(分子)=∑Ar(构成微粒的原子)
例题:求出水的相对分子质量
Mr(H2O)=2Ar(H)+Ar(O)=2×1+16=18