一氧化碳还原氧化铁的实证探索与教学思考
发布者:吾爱 来源:zhaojiaoan.com
总反应是:
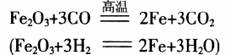
资料指出,温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。对于CO和H2的还原性则普遍认为:温度低于810℃,CO的还原性比H2要强;高于810℃,H2的还原性比CO要强。将Fe2O3在不超过1050℃的条件下通入H2,可使之还原成铁粉[4]。
文革前人教版的高中化学第三册(第一分册)的134页图29特地指出:“高炉炼铁的全部还原过程都是500℃~800℃在高炉的炉身部分完成的”。总反应式所标示的是“高温”,显然是代表Fe3O4→Fe,特别是代表FeO→Fe的还原过程所必需的反应条件。
2、实验室用酒精灯加热(400℃~500℃)的温和条件下,CO很难最终把Fe2O3还原成Fe
按上世纪80年代~90年代的高中化学教材所图示的装置(如图)和操作方法进行实验,即使还原过程长达30min以上,实验过程中你会发现:
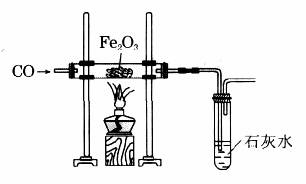
①不通CO,单独加热玻璃管里的Fe2O3粉末,粉末也会由“红棕”色逐渐变“黑”。所不同的是,粉末一旦冷却,又会恢复成加热前的红棕色。
②先通人CO,然后加热,玻璃管里的粉末会由红棕色逐渐变黑。问题是这种黑色粉末主要不是单质Fe。尽管它可以被磁铁吸引,但是它却不具有单质铁的其它的更为特征的性质。例如:用这种黑色粉末分做以下实验: